
Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Comment un embryon « mord » dans le tissu maternel: la mécanique de l'implantation chez l'homme filmée en temps réel pour la première fois
Dernière revue: 23.08.2025
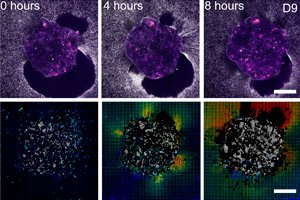 ">
">Des scientifiques de Barcelone (IBEC, Dexeus Mujer) et de Tel Aviv ont montré pour la première fois, en temps réel et en 3D, comment un embryon humain se fixe à l'« échafaudage utérin » et tire et restructure littéralement les tissus environnants. Pour ce faire, ils ont créé une plateforme ex vivo déformable (gels de collagène/ECM) et appliqué la microscopie à force de traction directement à des embryons humains et murins vivants. Principale découverte: le schéma des forces est spécifique à chaque espèce et les embryons eux-mêmes sont mécanosensibles: ils réagissent aux signaux mécaniques externes en restructurant le cytosquelette et en modifiant l'orientation de leur croissance.
Contexte de l'étude
L'implantation est le goulot d'étranglement de la reproduction humaine: c'est à ce stade que les conceptions naturelles et les tentatives de FIV échouent le plus souvent. Parallèlement, l'implantation humaine est interstitielle: l'embryon ne se contente pas de « coller », mais est complètement intégré à l'endomètre – un processus biochimiquement et mécaniquement complexe, mais jusqu'à récemment quasiment jamais observé chez l'humain. Par conséquent, les mécanismes d'adhésion et d'invasion restaient une « boîte noire », et les conclusions reposaient souvent sur des marqueurs indirects ou des données issues de modèles animaux.
La biologie classique de l'implantation s'est largement appuyée sur la souris, mais il existe des différences fondamentales entre les espèces, de l'orientation du blastocyste à la profondeur d'implantation, en passant par le schéma des forces cellulaires. Chez la souris, l'implantation est plus « superficielle », avec des directions préférentielles de déplacement des tissus; chez l'homme, elle est nettement invasive, avec des forces de traction multifocales autour de l'embryon. Ces différences suggèrent que le modèle murin n'est pas toujours adaptable à l'humain, notamment sur le plan mécanique. Des observations directes de l'embryon humain dans un environnement déformable étaient nécessaires.
Cette avancée technologique a été rendue possible grâce à la combinaison de matrices déformables 2D/3D (collagène/ECM) et de la microscopie à force de traction avec imagerie haute fréquence à long terme. Cet « utérus artificiel » a permis de voir et de mesurer concrètement comment l'embryon tire, restructure et « fore » les tissus environnants, ainsi que sa réaction aux signaux mécaniques externes (mécanosensibilité). Cela ouvre la voie à de nouveaux critères d'évaluation du potentiel d'implantation et à l'optimisation des conditions de transfert embryonnaire.
Le contexte est appliqué: si les propriétés mécaniques de l’environnement et le modèle de forces embryonnaires sont associés au succès de l’implantation, alors en FIV, il est possible de sélectionner de manière ciblée la rigidité/composition de la matrice, de prendre en compte les fenêtres temporelles de transfert et même d’utiliser des mesures de « force » comme marqueur de sélection supplémentaire. Parallèlement, de telles plateformes contribueront à expliquer la proportion de fausses couches précoces, lorsque la biochimie est « normale », mais que la mécanique d’adhésion ne l’est pas. Tout cela fait des observations 3D directes de l’implantation humaine non seulement une belle vidéo, mais un nouvel outil pour la médecine de la reproduction.
Pourquoi est-ce important?
L'échec d'implantation est l'une des principales causes d'infertilité et représente jusqu'à 60 % des fausses couches spontanées. Malgré les progrès biochimiques de la FIV, les mécanismes de ce processus chez l'homme restent méconnus. Une nouvelle approche permet d'observer les forces et les trajectoires de l'implantation embryonnaire et offre une base pour améliorer la sélection et les conditions de transfert des embryons.
Comment cela a été fait
Les chercheurs ont assemblé un « utérus artificiel » – un environnement souple, transparent et déformable dans lequel une matrice tissulaire se déplace visiblement sous l'influence des forces embryonnaires. Ils ont ensuite procédé à une microscopie continue et à une analyse informatique des déplacements des fibres.
- Plateformes 2D et 3D: en 3D, l’embryon est immédiatement intégré dans la matrice (l’étape d’attache est « bypassée »), ce qui permet de voir le perçage dans l’épaisseur du tissu.
- Haute « survie et pénétration » en 3D: environ 80 % d'invasion réussie (limitée par la proximité du verre).
- Les cartes de traction et la corrélation numérique du volume montrent les amplitudes et les directions des déplacements autour de l'embryon - essentiellement une « empreinte » de force au fil du temps.
Qu'est-ce qui a été trouvé exactement (brièvement et point par point)
1) Mécanique d'implantation spécifique à l'espèce
- Humain: l'embryon est inséré dans la matrice, créant de multiples foyers de traction et formant des déplacements radialement uniformes autour de lui; la profondeur d'invasion peut atteindre 200 µm.
- Souris: l'embryon s'étale principalement sur la surface avec des directions principales de déplacement prononcées.
2) L'embryon ressent la mécanique de l'environnement
- Forces externes → réponse: dans l'embryon humain - recrutement de myosine et de pseudopodes cellulaires dirigés; chez la souris - rotation de l'axe d'implantation/croissance vers la source de force externe (orientation de l'axe PD).
- Marqueurs mécanosensibles: chez la souris, changements dans la localisation de YAP dans le trophoblaste; ensemble, cela indique un circuit de rétroaction mécanosensible.
3) La relation entre la force et le succès de l'implantation
- Moins de déplacement de collagène → moins bonne progression de l’implantation chez les embryons humains.
- Intégrines - le « coupleur » de force: le blocage du peptide RGD/l'inhibition de Src chez la souris réduit la profondeur/zone d'implantation.
À quoi ressemble la mise en œuvre?
- Sur les plateformes 2D et 3D, un « halo » croissant de déplacements de fibres se forme autour de l’embryon; la carte de traction pulse comme si l’embryon « scannait » son environnement.
- Sur le verre, l'embryon humain forme une excroissance plate, mais dans une matrice molle, il reste plus sphérique et va plus en profondeur - comme dans un tissu vivant.
Qu'est-ce que cela apporte à la pratique (perspectives pour la FIV et pas seulement)
L'idée est simple: l'implantation ne se limite pas à la « chimie du récepteur », mais concerne également les mécanismes d'adhésion et de traction. Cela signifie que nous pouvons optimiser:
- Matériaux et dureté moyenne lors des tests de potentiel de culture/implantation;
- Nouveaux marqueurs pour la sélection des embryons - basés sur les trajectoires et l'amplitude des déplacements dans la matrice « intelligente »;
- Entraînement/modulation utérine (par exemple par des signaux mécaniques doux) pour améliorer l'adhésion sans interventions agressives.
Attention: le travail ex vivo ne se déroule pas « à l'intérieur de l'utérus ». Mais le simple fait qu'un signal mécanique externe modifie l'orientation de l'implantation/organisation des axes ouvre la voie à des conditions personnalisées de transfert d'embryons.
Restrictions
- Le modèle ex vivo ne prend pas en compte la dynamique immunitaire, hormonale et vasculaire de l’endomètre réel;
- Le Matrigel/collagène définit un ensemble de propriétés (rigidité, viscoélasticité, composition), il est difficile de les modifier par un seul paramètre;
- Les contraintes éthiques des études humaines (fenêtre jusqu'à 14 jours) limitent l'observation à long terme. Cependant, la forte concordance avec les modes d'implantation in vivo connus (interstitiel chez l'homme vs superficiel chez la souris) renforce la confiance dans le modèle.
Conclusion
L'embryon humain « attire » et « fore » activement son chemin vers le tissu maternel, et les signaux mécaniques de l'environnement peuvent reconfigurer son comportement. Le schéma des forces et la stratégie d'implantation diffèrent chez l'homme et la souris, ce qui pourrait expliquer pourquoi le modèle murin ne prédit pas toujours une implantation réussie chez l'homme. La mécanique est désormais un acteur à part entière de l'embryologie précoce et de la médecine de la reproduction.
Source: Godeau AL et al. La force de traction et la mécanosensibilité influent sur les schémas d'implantation spécifiques à l'espèce chez les embryons humains et murins. Science Advances 11(33): eadr5199 (15 août 2025). DOI: 10.1126/sciadv.adr519
