
Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
L'IA détecte un cancer de la prostate à un stade précoce, ignoré par les pathologistes
Dernière revue: 23.08.2025
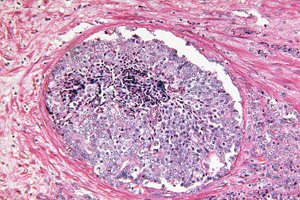 ">
">Des rapports scientifiques démontrent que l'intelligence artificielle peut reconnaître des indices morphologiques cachés de tumeurs dans des biopsies de prostate, jusqu'alors considérées comme bénignes par un pathologiste. Un modèle d'apprentissage profond, entraîné selon l'approche faiblement supervisée, a prédit quels hommes présentant un taux élevé de PSA développeraient un cancer de la prostate cliniquement significatif (ISUP > 1) dans les 30 mois suivants et lesquels resteraient indemnes de cancer pendant au moins 8 ans. Cela ouvre la voie à une stratification précoce du risque immédiatement après une première biopsie « propre » et pourrait aider à déterminer qui a réellement besoin de procédures invasives répétées et d'une surveillance renforcée.
Contexte de l'étude
La biopsie primaire à l'aiguille de la prostate donne souvent des résultats faussement négatifs: une proportion significative de cancers cliniquement significatifs reste « hors examen », notamment avec la biopsie TRUS systématique traditionnelle. L'introduction du guidage par IRM a augmenté la proportion de cancers cliniquement significatifs détectés et réduit le nombre de procédures répétées inutiles. Cependant, même avec les stratégies modernes, certaines tumeurs agressives restent non détectées. Le dilemme clinique reste le même: qui doit être observé après une biopsie « propre » et qui doit être adressé pour une biopsie répétée précoce, afin de ne pas retarder le diagnostic et de ne pas surcharger les patients d'interventions invasives.
La base biologique pour résoudre ce problème est le phénomène TINT (tumor-instructed/indicating normal tissue): une tumeur « reconfigure » les tissus environnants, apparemment normaux, de l'organe, y laissant des traces faibles mais systématiques – du remodelage stromal et de l'hypoxie aux changements métaboliques. Ces changements ont été décrits dans des modèles expérimentaux et chez des patients atteints d'un cancer de la prostate et sont corrélés à l'agressivité tumorale, ce qui fait du tissu « normal » une source potentielle de signaux diagnostiques, même en l'absence de glandes cancéreuses évidentes dans le noyau de biopsie.
La pathologie numérique et les méthodes d'apprentissage profond visent à extraire ces caractéristiques de champ « subtiles » à partir de coupes H&E standard. Contrairement à la morphologie classique, qui se concentre sur les structures tumorales évidentes, les algorithmes peuvent capturer des schémas distribués dans le stroma et l'épithélium associés à la présence d'une tumeur dans une autre partie de l'organe. Cela ouvre la voie à une stratification du risque immédiatement après une biopsie négative: un score de verre élevé suggère la nécessité d'une biopsie répétée précoce ou d'un guidage par IRM, tandis qu'un score faible justifie une observation plus douce.
C'est l'idée qui sous-tend une nouvelle étude publiée dans Scientific Reports: les auteurs ont testé si l'IA pouvait prédire un cancer de la prostate cliniquement significatif dans les 30 prochains mois, à partir d'indices morphologiques issus de biopsies TINT. Ces travaux s'appuient sur une prépublication précédemment présentée et constituent une base appliquée pour l'utilisation de biomarqueurs numériques de terrain dans le traitement des patients après une biopsie initiale « propre ».
Comment cela a été fait: conception, données, algorithme
Français Les auteurs ont collecté rétrospectivement une cohorte de 232 hommes avec un PSA élevé et une conclusion initiale de « bénin » à la biopsie à l'aiguille (après contrôle technique, 213 patients et 587 sections ont été inclus dans l'analyse finale; biopsies 1997-2016, Umea, Suède). Chaque patient a été apparié à une paire « miroir » par âge, année de diagnostic et taux de PSA: la moitié a reçu un diagnostic de cancer de la prostate plus tard (≤ 30 mois), l'autre moitié est restée sans cancer pendant au moins 8 ans. Les lames H&E ont été numérisées (20×), découpées en tuiles de 256×256 pixels et introduites dans CLAM (Clustering-constrained Attention Multiple-Instance Learning) - un schéma moderne faiblement supervisé, où seul le devenir du patient est connu, et non le marquage de chaque pixel. Les caractéristiques ont été extraites par ResNet18 pré-entraîné sur 57 ensembles de données histopathologiques. Le critère d’évaluation est binaire: faible risque (bénin/ISUP1) vs. risque élevé (ISUP2-5).
Précision des prédictions
Lors d'un test indépendant, le modèle a atteint une ASC de 0,81 sur l'ensemble des lames et une ASC de 0,82 à l'échelle du patient. À un seuil offrant un équilibre acceptable, la sensibilité était de 0,92 avec un taux de faux positifs de 0,32 (à l'échelle du patient). Autrement dit, parmi les personnes dont la biopsie initiale a été « manquée », l'IA a correctement identifié la grande majorité de celles dont le cancer cliniquement significatif a rapidement été confirmé, au prix de quelques fausses alertes. Pour le clinicien, c'est un signal: réponse « bénigne » à la biopsie ≠ risque nul, et elle peut être stratifiée quantitativement par verre numérique.
Que « remarque » exactement l’IA dans les tissus « normaux »?
L'interprétation via UMAP et les cartes d'attention ont montré que les changements stromaux sont les plus informatifs:
- Plus de collagène dans le stroma (compactage de la matrice, « fibrose »);
- Moins de cellules musculaires lisses autour des glandes;
- Les signaux subtils dans l'épithélium glandulaire sont moins fréquents, probablement en dessous de la résolution de sous-échantillonnage disponible.
Ce schéma s'inscrit dans le concept TINT (tumeur-instruite/indiquant un tissu normal): même la « norme » d'un organe où une tumeur est cachée est reconfigurée sous son influence et diffère de la « norme » d'un organe indemne de tumeur. Le cancer n'est pas seulement un foyer, mais aussi un champ, et l'IA apprend à lire l'effet de champ.
Comment l'approche est utile dans la pratique - scénarios potentiels
- Nouvelle biopsie basée sur le risque: taux d'IA élevé sur verre « propre » - argument en faveur d'une nouvelle biopsie précoce ou d'un guidage par IRM au lieu d'attendre.
- Personnalisation du monitoring: La faible vitesse contrebalance l’anxiété après une IRM « limite » et permet de modérer l’intensité du monitoring.
- Formation aux modèles TINT: les cartes d'attention et les superpositions interactives aident les pathologistes à voir les champs subtils autour du cancer, améliorant ainsi la cohérence des rapports.
Il est important de comprendre les limites
Il s'agit d'un centre unique situé dans le nord de la Suède (population majoritairement caucasienne). L'étude est rétrospective, les biopsies initiales ont été réalisées sans guidage par IRM (biopsies TRUS systématiques) et les marqueurs sont des résultats futurs plutôt que la présence d'une tumeur occulte sur la même lame. Il n'existe pas encore de validation externe dans des centres/scanners indépendants, ni d'essai prospectif sur l'effet de l'algorithme sur les décisions et les résultats cliniques. Le taux de faux positifs reste significatif; le modèle ne remplace pas le médecin, mais ajoute une dimension probabiliste pour la prise de décision partagée.
Prochaines étapes: feuille de route de mise en œuvre
- Validation externe multicentrique (différents scanners, protocoles, ethnies).
- Études de décision prospectives: le score d'IA modifie-t-il la trajectoire du patient (délai de diagnostic, nombre de biopsies répétées inutiles, sur/sous-diagnostic).
- Intégration avec l'IRM et la clinique: modèles combinés (PSA, IRM PIRADS, facteurs cliniques + score TINT selon H&E).
- Étapes techniques: standardisation de la digitalisation, contrôle de la dérive des données, explicabilité (superpositions d'attention pour la routine).
Source: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C., et al. Découverte de tumeurs indiquant des modifications morphologiques dans des biopsies bénignes de prostate grâce à l'IA. Rapports scientifiques (Nature Portfolio), publié le 21 août 2025. DOI: https://doi.org/10.1038/s41598-025-15105-6
