
Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Neuroprothèse pour le tractus gastro-intestinal: restaure le péristaltisme et active les « hormones de satiété »
Dernière revue: 18.08.2025
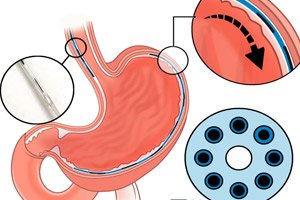 ">
">Les troubles de la motilité gastro-intestinale (œsophage et estomac) – achalasie, gastroparésie, dysphagie, etc. – touchent plus de 20 % de la population et sont à l'origine d'une morbidité et de coûts importants. Les approches classiques – médicaments, interventions comportementales et chirurgie – ont souvent une efficacité limitée et ne permettent pas de rétablir un péristaltisme coordonné.
- Pourquoi les dispositifs existants ne résolvent pas le problème. La stimulation électrique du tractus gastro-intestinal est étudiée depuis les années 1960, mais les implants approuvés cliniquement (par exemple, Enterra pour la gastroparésie, les stimulateurs vagaux VBLOC pour l'obésité, la stimulation sacrée InterStim pour l'incontinence fécale) fonctionnent principalement en boucle ouverte et produisent souvent des effets incohérents sur la vidange gastrique. La raison en est qu'une ou plusieurs sources de courant à paramètres constants ne reproduisent pas la complexité spatio-temporelle du péristaltisme naturel.
- Physiologie à « imiter ». Le péristaltisme est une boucle fermée: signaux sensoriels (étirement, température, stimuli chimiques) → réponses réflexes dans le plexus myentérique et les muscles lisses. Outre le transport des aliments, la motilité affecte les signaux intestin-cerveau afférents et les hormones de satiété (GLP-1, insuline, ghréline), provoquant l'appétit et une sensation de satiété. En cas de dysmotilité, ces boucles sont perturbées.
- Lacune technologique. Pour reproduire les ondes « correctes », une stimulation multicanal est nécessaire directement à proximité du plexus myentérique et de la couche musculaire. Mais cet accès nécessite généralement une intervention chirurgicale invasive; les techniques endoscopiques avancées (par exemple, NOTES) sont complexes et peu répandues. Des instruments mini-invasifs sont nécessaires pour permettre un positionnement précis des électrodes dans la sous-muqueuse et fonctionner en boucle fermée « détection → stimulation ».
- Ce que propose cette nouvelle étude. Les auteurs décrivent une neuroprothèse multicanal installée par endoscopie, avec stimulation électrique et chimique, capable de déclencher des ondes péristaltiques coordonnées lors d'un signal de passage d'un bolus, rétablissant ainsi non seulement la motilité, mais aussi modulant la réponse métabolique (la rapprochant ainsi d'un état « alimenté »). Cela comble des lacunes clés: accès à la couche souhaitée, coordination spatio-temporelle et fonctionnement en boucle fermée.
En bref, il existe une niche clinique importante: les démotivations sont répandues et mal traitées. Les stimulants « ouverts » précédents n'imitent pas la physiologie naturelle. Il est donc logique d'essayer d'apprendre à l'implant à « penser comme le tube digestif »: à détecter le bol alimentaire et à déclencher le péristaltisme physiologique exactement là où le signal naturel passe, au niveau du plexus myentérique.
Une équipe du MIT, de Harvard et de Brigham Young a créé un implant œsophagien/estomac miniature qui détecte un bol alimentaire en boucle fermée et déclenche des ondes péristaltiques coordonnées. Chez le porc, le dispositif a non seulement restauré la motilité œsophagienne et gastrique, mais a également induit des changements hormonaux similaires à ceux observés après un repas. L'implant est placé par voie endoscopique, sans chirurgie abdominale. L'étude a été publiée dans la revue Nature.
Qu'ont-ils inventé?
- L'implant lui-même. Il s'agit d'une neuroprothèse « fibreuse » fine d'un diamètre d'environ 1,25 mm, dotée de sept électrodes tous les 1 cm et d'un microcanal pour l'administration locale de substances (électrostimulation et chimiostimulation). Sa flexibilité et ses dimensions permettent son insertion par le canal standard d'un endoscope (2,8–3,2 mm).
- Installation. Un instrument endoscopique a été développé: une aiguille avec traction inverse d'un « crochet » en nitinol, une hydrodissection et, l'astuce clé - la recherche de la sous-muqueuse par impédance tissulaire pour un placement précis juste au-dessus de la couche musculaire, près du plexus myentérique.
- Boucle fermée. Le système lit le signal du bolus (EMG/capteurs intraluminaux) et sélectionne un schéma de stimulation pour induire des contractions séquentielles similaires au péristaltisme naturel. Il est possible de combiner des stimuli « excitateurs » et « inhibiteurs », ainsi que de détendre localement les sphincters grâce à des microdoses de médicaments.
Ce qui a été montré sur les animaux
- Œsophage: L'implant a produit des « ondes de déglutition » sans déglutition réelle, y compris une relaxation contrôlée du sphincter œsophagien inférieur (via une micro-administration de glucagon) et des ondes avant/rétrogrades programmables, essentiellement un « joystick » péristaltique.
- Estomac. Après 20 minutes de stimulation, la fréquence du péristaltisme a augmenté d'environ deux fois par rapport au témoin (n≈4, p<0,05).
- « Illusion de satiété » métabolique. À jeun, une stimulation de 30 minutes (œsophagienne ou gastrique) a entraîné des modifications hormonales: augmentation du GLP-1 et de l'insuline, diminution de la ghréline (hormone de l'appétit); avec la stimulation gastrique, une augmentation du glucagon a également été observée. Le profil global ressemblait à celui de l'état postprandial.
Détails de sécurité et d'ingénierie
De courts tests de biocompatibilité in vitro (extraits de matériaux) n'ont montré aucune toxicité; in vivo, 7 jours après implantation, l'extensibilité de la paroi était normale et aucune migration du dispositif ni lésion tissulaire importante n'a été observée. (Des tests à long terme sont nécessaires pour garantir une durabilité et une fiabilité accrues.)
Pourquoi est-ce nécessaire?
- Troubles de la motilité et affections réfractaires. Achalasie, gastroparésie, dysphagie, troubles postopératoires – les traitements/interventions classiques ont souvent un effet incomplet. La stimulation multicanal locale est plus proche de la physiologie réelle que les implants monocanaux en boucle ouverte existants.
- Troubles métaboliques. En contrôlant les voies afférentes intestin-cerveau, le dispositif pourrait potentiellement moduler l'appétit et le métabolisme, ce qui est intéressant pour l'obésité et le diabète (hypothèse à ce jour, aucune preuve chez l'homme).
Limites et prochaines étapes
Il s'agit de travaux précliniques sur des porcs, en phase aiguë-subaiguë. Des études à long terme sur la stabilité du contact, l'apport énergétique, le risque de fibrose, des protocoles de stimulation précis sont à venir, puis des essais cliniques préliminaires sur des patients présentant des formes sévères de dysmotricité ont été réalisés. Il a toutefois déjà été démontré que le péristaltisme peut être activé sur commande et que les réponses hormonales peuvent être orientées vers la satiété, le tout par voie endoscopique.
