
Tout le contenu iLive fait l'objet d'un examen médical ou d'une vérification des faits pour assurer autant que possible l'exactitude factuelle.
Nous appliquons des directives strictes en matière d’approvisionnement et ne proposons que des liens vers des sites de médias réputés, des instituts de recherche universitaires et, dans la mesure du possible, des études évaluées par des pairs sur le plan médical. Notez que les nombres entre parenthèses ([1], [2], etc.) sont des liens cliquables vers ces études.
Si vous estimez qu'un contenu quelconque de notre contenu est inexact, obsolète ou discutable, veuillez le sélectionner et appuyer sur Ctrl + Entrée.
Microadénome hypophysaire: causes, symptômes, danger, pronostic
Expert médical de l'article
Dernière revue: 12.07.2025
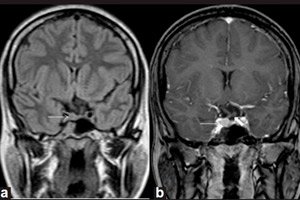
Les néoplasmes bénins qui apparaissent dans les glandes endocrines sont appelés adénomes, et un microadénome de l'hypophyse est une petite tumeur de son lobe antérieur, qui produit un certain nombre d'hormones importantes.
Épidémiologie
L'incidence des tumeurs hypophysaires est estimée à 10-23 %, et les adénomes hypophysaires, qui peuvent avoir diverses formes et tailles, sont les plus courants (16 %).[ 1 ]
Jusqu'à 20 à 25 % des personnes peuvent avoir de petites tumeurs hypophysaires, des microadénomes, sans même le savoir, et ces tumeurs sont découvertes par hasard lors d'une imagerie cérébrale dans environ la moitié des cas.
Les microadénomes sécrétant de la prolactine représentent 45 à 75 % de ces tumeurs; les formations productrices d'ACTH ne représentent pas plus de 14 % des cas et la fréquence des microadénomes producteurs de STH ne dépasse pas 2 %.
Le microadénome de l'hypophyse chez les enfants et les adolescents est détecté dans 10,7 à 28 % des cas, et au moins la moitié d'entre eux sont hormonalement inactifs. [ 2 ]
Causes microadénomes hypophysaires
Les experts ne connaissent pas les raisons exactes de l'apparition du microadénome dans l'hypophyse, une glande endocrine du cerveau dont les cellules produisent:
- corticotropine ou ACTH – hormone adrénocorticotrope, qui provoque la sécrétion d’hormones stéroïdes par le cortex surrénalien;
- hormone de croissance STH – hormone somatotrope;
- gonadotrophines FSH – hormone folliculo-stimulante et LH – hormone lutéinisante, qui déterminent la production d’hormones sexuelles féminines dans les ovaires et d’hormones sexuelles mâles dans les testicules;
- hormone lactogène prolactine (PRL);
- la thyrotropine ou hormone stimulant la thyroïde (TSH), qui stimule la synthèse des hormones par la glande thyroïde.
On pense que le développement de ces néoplasmes peut être causé par un traumatisme crânien, un apport sanguin insuffisant à l’hypophyse, des infections cérébrales ou une exposition à des toxines (provoquant un œdème et une hypertension intracrânienne).
Facteurs de risque
Il est connu que les adénomes et microadénomes hypophysaires surviennent plus fréquemment en présence d'antécédents familiaux de syndrome NEM 1 ( adénomatose endocrinienne multiple de type 1), qui est héréditaire. Il existe donc des facteurs de risque génétiquement déterminés associés à certaines modifications de l'ADN. [ 3 ]
Néoplasie endocrinienne multiple de type 4 (MEN4): la MEN 4 présente une mutation dans le gène de l'inhibiteur de la kinase dépendante de la cycline 1 B (CDKN1B), qui se caractérise par des tumeurs hypophysaires, une hyperparathyroïdie, des tumeurs neuroendocrines des testicules et du col de l'utérus.[ 4 ]
Complexe de Carney (CNC): Dans le complexe de Carney, il existe une mutation germinale dans le gène suppresseur de tumeur PRKAR1A conduisant à une maladie surrénalienne nodulaire pigmentée primaire (PPNAD), à des tumeurs testiculaires, à des nodules thyroïdiens, à une hyperpigmentation cutanée en plaques et à une acromégalie.[ 5 ]
La forme clinique des adénomes hypophysaires isolés familiaux (FIPA) est caractérisée par des défauts génétiques dans le gène de la protéine interagissant avec le récepteur des hydrocarbures aryles (AIP), dans environ 15 % de toutes les familles apparentées et 50 % des familles homogènes de somatotropines.[ 6 ]
Adénomes hypophysaires familiaux isolés (APFI): Une mutation de la protéine interagissant avec le récepteur des arylhydrocarbures (AIP) est détectée à l'adolescence ou au début de l'âge adulte dans environ 15 % des cas d'APFI. Ces tumeurs sont généralement agressives et sécrètent le plus souvent de l'hormone de croissance, provoquant une acromégalie.[ 7 ]
La possibilité que ce type de tumeur survienne à la suite de troubles fonctionnels d'autres glandes endocrines et structures cérébrales, en particulier de modifications du système vasculaire de l'hypothalamus, qui, au sein du système neuroendocrinien hypothalamo-hypophysaire, régule le fonctionnement de l'hypophyse et de son lobe antérieur, l'adénohypophyse, avec ses hormones de libération, n'est pas exclue.
Pathogénèse
Selon son histologie, l'adénome hypophysaire est une tumeur bénigne; selon la taille, ces néoplasmes sont divisés en microadénomes (jusqu'à 10 mm de taille au point le plus large), macroadénomes (10-40 mm) et adénomes géants (40 mm ou plus).
Lors de l'étude de la pathogénèse de la formation de tumeurs dans l'hypophyse, il n'a pas encore été possible de déterminer les mécanismes de transformation hyperplasique des cellules de son lobe antérieur en tumeur.
Les experts estiment que l'une des versions les plus convaincantes est un lien avec la dérégulation du métabolisme du neurotransmetteur et de l'hormone dopamine (qui est le principal inhibiteur de la sécrétion de prolactine) et/ou une perturbation des fonctions des récepteurs transmembranaires de la dopamine des cellules hypophysaires qui sécrètent la PRL (lactotrophes).
La plupart des microadénomes hypophysaires sont sporadiques, mais certains surviennent dans le cadre de syndromes neuroendocriniens d'origine génétique, tels que la NEM 1, le syndrome de McCune-Albright, le syndrome de Werner et le syndrome de Carney (ou complexe de Carney). Ce dernier est associé à un risque accru de développer des tumeurs bénignes des glandes hormonales (endocrines), notamment l'hypophyse, les surrénales, la thyroïde, les ovaires et les testicules.
Symptômes microadénomes hypophysaires
Un microadénome hypophysaire peut rester asymptomatique pendant très longtemps. Les symptômes varient selon la localisation et résultent généralement d'un dysfonctionnement endocrinien. C'est le diagnostic le plus fréquent en cas de déséquilibre hormonal associé à une production excessive d'une ou plusieurs hormones. Dans la plupart des cas, selon la localisation, il s'agit d'un microadénome de l'hypophyse antérieure.
Il existe différents types de microadénomes hypophysaires selon leur activité hormonale. Ainsi, le type le plus courant est considéré comme un adénome non fonctionnel – un microadénome hypophysaire inactif sur le plan hormonal, qui, jusqu'à ce qu'il atteigne une certaine taille, ne provoque aucun symptôme. Cependant, un microadénome hypophysaire inactif sur le plan hormonal en croissance peut comprimer les structures cérébrales ou les nerfs crâniens voisins. Un microadénome hypophysaire peut donc être associé à des céphalées frontales et temporales [ 8 ] et des troubles de la vision sont également possibles [ 9 ]. Cependant, comme l'affirment les chercheurs, les tumeurs hypophysaires non fonctionnelles (hormonalement inactives) sont dans 96,5 % des cas des macroadénomes [ 10 ].
Un microadénome hypophysaire (lobe antérieur) à activité hormonale, associé à une sécrétion accrue de prolactine, peut également survenir. L'augmentation de la production de PRL par les cellules lactotropes de l'adénohypophyse est définie comme une hyperprolactinémie dans le microadénome hypophysaire .
Comment un tel microadénome hypophysaire se manifeste-t-il chez la femme? Des taux anormalement élevés de cette hormone inhibent la production d'œstrogènes, et les premiers signes se manifestent par des troubles du cycle menstruel, avec absence de règles (aménorrhée) et/ou de phase ovulatoire. Il en résulte un syndrome persistant de galactorrhée-aménorrhée, entraînant la perte de la capacité à concevoir et à devenir enceinte.
Le microadénome hypophysaire sécrétant de la prolactine chez l'homme peut entraîner un hypogonadisme hyperprolactinémique avec diminution de la libido, dysfonction érectile, hypertrophie des seins (gynécomastie) et diminution de la pilosité faciale et corporelle.
Le micro-œdème actif sécrétant de la corticotropine (ACTH) entraîne un excès d'hormones stéroïdes (glucocorticoïdes) produites par le cortex surrénalien, ce qui peut provoquer la maladie d'Itsenko-Cushing d'étiologie hypophysaire.
Chez les enfants, un tel microadénome peut se manifester par des symptômes d'hypercorticisme (syndrome de Cushing), notamment des maux de tête, une faiblesse générale, un dépôt excessif de tissu adipeux sur le tronc, une diminution de la densité minérale osseuse et de la force musculaire, une atrophie cutanée en forme de bande (sous forme de stries violettes), etc.
En cas de microadénome actif produisant de la somatotropine, le taux de STH dans l'organisme augmente. Chez l'enfant, son effet anabolisant excessif stimule la croissance de la quasi-totalité des os et peut entraîner un gigantisme; chez l'adulte, l'acromégalie peut se développer avec une croissance accrue des os du visage (entraînant une distorsion de l'apparence) et du cartilage des articulations des extrémités (entraînant une perturbation de leurs proportions et un épaississement des doigts), des douleurs articulaires, une transpiration et une sécrétion de sébum excessives, et une intolérance au glucose.
Très rarement (dans 1 à 1,5 % des cas), il existe un microadénome de l'hypophyse qui produit de la thyrotropine, et comme cette hormone a un effet stimulant sur la glande thyroïde, les patients présentent des signes cliniques d'hyperthyroïdie hypophysaire sous forme de tachycardie sinusale et de fibrillation auriculaire du cœur, augmentation de la pression artérielle, diminution du poids corporel (avec augmentation de l'appétit), ainsi qu'une excitabilité nerveuse et une irritabilité accrues.
Le microadénome hypophysaire intrasellaire, synonyme de microadénome hypophysaire endosellaire, comme l'hypophyse entière, est localisé dans la selle turcique, à l'intérieur de la dépression anatomique en forme de selle de l'os sphénoïde à la base du crâne. L'hypophyse est située au fond de cette dépression, dans la fosse pituitaire (région intrasellaire). La seule différence réside dans le fait que « à l'intérieur » se dit « intra » en latin et « endom » en grec.
Mais un microadénome hypophysaire avec croissance suprasellaire signifie que le néoplasme se développe vers le haut à partir du bas de la fosse pituitaire.
Le microadénome kystique de l'hypophyse a une structure en forme de sac fermé et est une formation asymptomatique.
Le microadénome de l'hypophyse avec hémorragie peut être le résultat d'une apoplexie ou d'un infarctus hémorragique associé à une hypertrophie de la glande et à des lésions des capillaires sinusoïdaux du parenchyme de son lobe antérieur, des synapses neurohémales et/ou des vaisseaux portes.
Microadénome de l'hypophyse et grossesse
Comme indiqué précédemment, les femmes atteintes d'un microadénome hypophysaire producteur de prolactine sont généralement infertiles en raison d'un déficit en œstrogènes et d'une suppression de la sécrétion pulsatile de GnRH (hormone de libération des gonadotrophines). Pour devenir enceinte, le taux de prolactine doit être normalisé, faute de quoi la conception ne se produit pas ou la grossesse est interrompue dès le début.
- Est-il possible d’accoucher avec un microadénome hypophysaire?
Chez les femmes atteintes de microadénomes cliniquement fonctionnels qui sont traitées avec des agonistes de la dopamine (Cabergoline ou Dostinex), les niveaux de prolactine peuvent se normaliser et les cycles menstruels et la fertilité peuvent être restaurés.
L’allaitement est-il possible en cas de microadénome hypophysaire?
En période post-partum, l'allaitement est autorisé en l'absence de symptômes de la tumeur, mais il est nécessaire de surveiller sa taille (par imagerie par résonance magnétique cérébrale). Si la tumeur grossit, l'allaitement est interrompu.
- Microadénome de l'hypophyse et FIV
Le traitement de l’hyperprolactinémie est nécessaire pour la FIV, et la procédure peut être initiée si les niveaux normaux de prolactine sont stables depuis 12 mois et qu’il n’y a aucune anomalie dans les niveaux sériques d’autres hormones hypophysaires.
Complications et conséquences
Quels sont les dangers du microadénome hypophysaire? Bien que bénigne, cette tumeur peut entraîner des complications et avoir des conséquences, notamment:
- conduire à un dysfonctionnement du système hypothalamo-hypophyso-surrénalien avec le développement de la maladie d'Itsenko-Cushing;
- perturber la régulation hormonale du cycle menstruel chez la femme et entraîner une dysfonction érectile chez l’homme;
- provoquer un retard de croissance et un nanisme hypophysaire (hypopituitarisme) chez les enfants;
- provoquer le développement de l’ostéoporose.
Lorsqu'une tumeur en croissance comprime les fibres du nerf optique au niveau de leur croisement (qui, chez 80 % des personnes, se situe directement au-dessus de l'hypophyse), on observe une altération de la mobilité oculaire (ophtalmoplégie) et une détérioration progressive de la vision périphérique. Cependant, les microadénomes sont généralement trop petits pour exercer une telle pression.
Un microadénome hypophysaire peut-il se résorber? Il ne peut pas se résorber, mais avec le temps, une tumeur inactive sur le plan hormonal peut diminuer significativement chez l'enfant. Cependant, chez environ 10 % des patients, les microadénomes peuvent augmenter de taille.
Diagnostics microadénomes hypophysaires
Pour diagnostiquer un microadénome hypophysaire, une anamnèse complète du patient et des tests de laboratoire sont nécessaires: analyses sanguines pour les taux d'hormones (produites par l'hypophyse), y compris un dosage radio-immunologique du sérum sanguin pour les taux de prolactine.
Si la prolactine est normale en présence d'un microadénome hypophysaire, cette tumeur est alors inactive sur le plan hormonal. En revanche, en présence de symptômes de prolactinome, un tel résultat faussement négatif peut être dû soit à une erreur de laboratoire, soit au développement d'un macroadénome comprimant la tige pituitaire.
En outre, des tests supplémentaires peuvent être nécessaires, par exemple pour le taux d'hormones thyroïdiennes (T3 et T4), d'immunoglobulines, d'interleukine-6 dans le sérum sanguin.
Le microadénome ne peut être détecté que par un diagnostic instrumental utilisant l'imagerie par résonance magnétique (IRM) du cerveau. L'IRM pour le microadénome est considérée comme la visualisation standard, avec une sensibilité de 90 % avec rehaussement de contraste.
Les signes IRM du microadénome hypophysaire comprennent: le volume de la glande du côté du microadénome; une augmentation de la taille de la selle turcique; un amincissement et des modifications du contour de son fundus (paroi inférieure); une déviation latérale de l'infundibulum hypophysaire; une isointensité de la zone arrondie par rapport à la matière grise sur les images pondérées en T1 et T2; une légère hyperintensité sur les images pondérées en T2. [ 11 ]
Diagnostic différentiel
Le diagnostic différentiel est réalisé avec le craniopharyngiome, la tumeur à cellules granuleuses (choristome) de l'hypophyse, le kyste de la poche de Rathke, la formation dermoïde, l'inflammation de l'hypophyse - hypophysite auto-immune ou lymphocytaire, le phéochromocytome, les maladies thyroïdiennes, etc.
Chez les femmes ayant un cycle anovulatoire, on distingue le microadénome hypophysaire et le syndrome des ovaires polykystiques, puisque 75 à 90 % des cas d'absence d'ovulation sont une conséquence du syndrome des ovaires polykystiques.
Qui contacter?
Traitement microadénomes hypophysaires
En cas d'adénomes et de microadénomes hypophysaires, le traitement peut être médical ou chirurgical. Si les tumeurs sont asymptomatiques, il est recommandé de les surveiller, c'est-à-dire de réaliser régulièrement une IRM, afin de ne pas manquer le début de leur croissance.
La prescription d’un médicament particulier est déterminée par le type de tumeur dont souffre le patient.
La pharmacothérapie des tumeurs sécrétant de la PRL est réalisée avec des médicaments du groupe des stimulateurs des récepteurs de la dopamine D2 de l'hypothalamus (agonistes sélectifs de la dopamine), et les plus souvent utilisés sont la bromocriptine (Parlodel, Bromergol), le Norprolac et le dérivé de l'ergot Cabergoline ou Dostinex pour le microadénome hypophysaire avec sécrétion accrue de prolactine.
Les effets secondaires du Dostinex (Cabergoline) peuvent inclure des réactions allergiques; des maux de tête et des étourdissements; des nausées, des vomissements et des douleurs abdominales; de la constipation; une sensation de faiblesse ou de fatigue; des troubles du sommeil. Parmi les effets secondaires de la bromocriptine (outre les réactions allergiques) figurent des douleurs thoraciques; une accélération du rythme cardiaque et une respiration avec sensation d'essoufflement; des crachats de sang; une détérioration de la coordination des mouvements, etc.
Les médicaments Octreotide (Sandostatine), Lanreotide (Somatuline), Pegvisomant, utilisés pour les micro- et macroadénomes qui sécrètent l'hormone de croissance, sont des inhibiteurs de l'hormone de croissance et des antagonistes de ses récepteurs.
Et pour les néoplasmes sécrétant de l'ACTH de l'adénohypophyse avec syndrome d'Itsenko-Cushing, on utilise la métyrapone (Metopirone) ou le mitotane (Lysodren).
Un traitement chirurgical doit être envisagé pour les microadénomes fonctionnels (hormono-actifs). En cas d'inefficacité du traitement conservateur et de légère expansion suprasellaire de la tumeur au sein de la selle turcique, une adénomectomie hypophysaire (intervention visant à retirer le microadénome hypophysaire) peut être prescrite. Actuellement, on pratique une microdissection transnasale ou transsphénoïdale, c'est-à-dire l'ablation du microadénome hypophysaire par le nez.
Les complications et conséquences possibles de l’ablation du microadénome hypophysaire comprennent des saignements postopératoires et une fuite de liquide céphalorachidien (nécessitant souvent une réopération), ainsi qu’une inflammation des méninges, une déficience visuelle, la formation d’hématomes, un diabète insipide transitoire et une récidive du microadénome.
L'homéopathie pour le microadénome hypophysaire avec hyperprolactinémie utilise des médicaments dont l'action peut soulager partiellement les symptômes. Par exemple, en cas de règles irrégulières et d'aménorrhée, on prescrit un remède à base d'encre de seiche (Sépia) et un remède à base de pulsatille des prés (Pulsatilla), et en cas de galactorrhée, un remède à base de racine de cyclamen européen.
Il ne faut évidemment pas espérer que les traitements traditionnels du microadénome hypophysaire soient plus efficaces. Et ce, non seulement parce que les herboristes se basent uniquement sur les plaintes des patients pour ce diagnostic (sans connaître leur véritable étiologie), mais aussi en raison du manque de fiabilité de nombreux remèdes traditionnels. Nul besoin de chercher bien loin pour trouver des exemples.
Certaines sources Internet recommandent d'utiliser un mélange d'onagre, de racine de gingembre et de graines de sésame pour réduire le taux de prolactine. Or, l'onagre aide à soulager la toux sèche prolongée et à fluidifier les mucosités, et la racine de gingembre, comme les graines de sésame, possède des propriétés lactogènes.
On peut également conseiller de prendre une teinture de cimicaire. En réalité, ce remède est utilisé en usage interne contre les flatulences et en usage externe contre les douleurs articulaires rhumatismales. Il est fort probable que la cimicaire ait été confondue avec les racines de l'actée à grappes noires (également appelées cimicaire noire et cimicaire à grappes noires), utilisées contre les bouffées de chaleur de la ménopause.
L'alimentation en cas de microadénome hypophysaire doit être équilibrée, avec une consommation réduite de sucre et de sel. Il ne s'agit pas d'un régime spécifique, mais simplement d'un régime moins calorique.
L'alcool est exclu en cas de microadénome hypophysaire.
Quel médecin consulter pour un microadénome hypophysaire? Les endocrinologues, les gynécologues et les neurochirurgiens prennent en charge les problèmes liés à ce type de tumeur.
La prévention
Étant donné que les causes environnementales ou liées au mode de vie des tumeurs hypophysaires sont inconnues, il n’existe tout simplement aucun moyen de prévenir le développement de microadénomes hypophysaires.
Prévoir
La plupart des tumeurs hypophysaires sont curables. Si un microadénome hypophysaire hormonalement actif est diagnostiqué à temps, les chances de guérison sont élevées et le pronostic est favorable.
Handicap et microadénome hypophysaire: le handicap peut être associé à la croissance tumorale et à une atteinte du nerf optique, ainsi qu'à d'autres conséquences de cette pathologie, dont la gravité varie d'un patient à l'autre. La reconnaissance du handicap dépend des problèmes de santé existants et de l'importance des troubles fonctionnels, qui doivent répondre à des critères approuvés par la loi.
Microadénome de l'hypophyse et de l'armée: les patients atteints de cette tumeur (même si elle est retirée avec succès) ne doivent pas surchauffer, s'exposer au soleil trop longtemps ni se surmener physiquement. Ils ne sont donc pas aptes au service militaire.
Quelle est l'espérance de vie d'une personne atteinte d'un microadénome hypophysaire? Cette tumeur n'est pas cancéreuse; il n'y a donc pas de limite d'espérance de vie. Cependant, en cas de microadénome actif produisant des géohelminthiases, les patients peuvent développer une hypertension et une augmentation de la taille du cœur, ce qui peut réduire considérablement leur espérance de vie. Un risque accru de décès est observé chez les patients de plus de 45 ans atteints de la maladie d'Itsenko-Cushing et d'acromégalie.

